- 时间: 1623326191932
- 来源: 侨报网综合
【侨报网综合讯】台湾疫情严峻,疫苗短缺,但民进党当局却一直力捧台湾自产疫苗,给自己减压。台湾高端疫苗公司10日公告二期临床数据,结果显示安全性与耐受性良好。不过根据台卫福部书面报告指出,采用mRNA技术的莫德纳、辉瑞等国际疫苗,安全、有效性,及处理病毒株快速变异性均为上选。
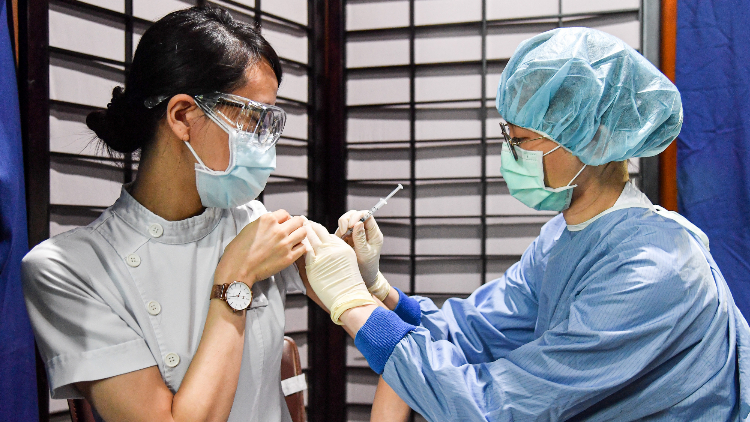
台北慈济医院10日为医护人员施打莫德纳(Moderna)疫苗,一名护理人员配戴护目镜接种疫苗。(图片来源:中央社)
台湾自产疫苗不易应付变种病毒
台北中时新闻网报道,据报道,台卫福部长陈时中10日赴立法院报告防疫纾困预算。此次扩大防疫纾困预算中,有关疫苗、药品临床试验、采购及检验的经费,本次追加约267.17亿元(新台币,下同),加上先前编列的约138.5亿元,合共约405.67亿元,其中包括进行核酸疫苗临床试验等所需的1.99亿元。
根据台卫福部报告称,岛内疫苗厂使用的重组蛋白技术,开发期程相较mRNA(信使核糖核酸)疫苗较长,也“不易应付容易突变的新型冠状病毒(变种病毒)”,所以要特别追加建立mRNA疫苗自主生产技术的预算。
报道称,报告提到,根据国际临床实验及各国大规模施打的经验,mRNA疫苗(莫德纳、辉瑞疫苗)的安全及有效性,及处理病毒株快速变异性均为上选。
据此前媒体报道,台卫生福利部疾病管制署于5月28日与高端疫苗公司及联亚生技开发公司签订新冠疫苗采购契约,每家各500万剂疫苗,并视未来疫情需求,纳入后续扩充每家各500万剂疫苗。
台湾高端疫苗拼7月开始施打
值得注意的是,综合中央社、香港中评社报道,台湾高端疫苗公司当地时间10下午5时召开记者会,宣布“解盲”成功。高端表示,近期将依法申请台湾紧急使用授权(EUA),力拼下半年开始供应新冠疫苗。
高端公告二期临床数据结果显示,疫苗安全性与耐受性良好,所有受试者未出现疫苗相关严重不良反应。
据悉,高端将尽快将期间分析报告、以及研发相关文件,送交至台食药署进行紧急授权使用审查,并尽速向欧盟EMA及其他国际药证主管机关咨询及申请第三期临床试验。
同时,在免疫生成性部分,不区分年龄组情况下,疫苗组在施打第二剂后28天的血清阳转率达99.8%。中和抗体之几何平均效价(GMT titer)为662,GMT倍率比值为163倍增加。其中20岁至64岁之疫苗组,血清阳转率则为99.9%,中和抗体几何平均效价(GMT titer)为733,GMT倍率比值为180倍增加,期间分析数据合于预期。
什么是“解盲”?
高端公布疫苗“解盲”结果,是指二期临床试验数据“安全性”与“免疫生成性”两大项,“免疫生成性”就是指抗体在人体内的浓度。
不少人好奇究竟什么是“解盲”,台湾医师陈志金近日在社交媒体上发文表示,在研究药效的临床试验,一般会以接受药物的“实验组”和没有接受药物“对照组”来进行各种成效或数据的比较。为了避免人为“偏差”,会以“双盲”的方式进行比较。
陈志金解释,简单来说受试者和研究者都不知道哪些人是被分配在实验组和对照组。在疫苗研究中,“实验组”会被注射真的疫苗,“对照组”则会被注射没有疗效的安慰剂,而这两“针”会用密码编号,依编码规则随机分配给受试者,外观上几乎一模一样。因此受试者与研究者都不知道谁被打了什么,这就叫做“双盲”。
陈志金表示,当研究结束、资料收集完成后,就会进行“解盲”的动作,也就是依照之前的随机编码方式,译码恢复“链接”,让负责分析资料的人知道哪一组数据数据是属于打疫苗的人,哪一组是属于打安慰剂的人,进行比较分析。
今年高端提供1000万剂疫苗
据悉,二期临床试验数据达到食品药物管理署标准,就可顺利向食药署申请紧急授权许可(EUA)。食药署10日也公布新冠疫苗疗效评估标准与紧急使用授权审查标准,除了要有3000名受试者资料以确保疫苗安全性,台产疫苗受试者体内中和抗体效价也不得低于接种阿斯利康(AZ)疫苗者,是评估疫苗有效性关键。
而民众最关心二期通过“解盲”,何时可以量产提供民众施打,高端疫苗总经理陈灿坚表示,目前备料已经准备好了,当前原物料供应无虞,现在就等紧急授权通过,预计今年可以配合政府、提供1000万剂疫苗。(完)






继续加载...